イメージング研究からインスリン分泌機構の解明を目指す
私たちの研究室はインスリン分泌をテーマに研究を行っています。糖尿病は血糖値が高くなる病気ですが、原因の一つにあるのが膵β細胞からのインスリン分泌の低下です。 しかしインスリン分泌のメカニズムは、全てが解明されているわけではありません。 私たちは膵β細胞に特化した新しいイメージングシステムを開発することにより、インスリン分泌の分子機構を解明しています。 私たちの研究は新しい糖尿病薬や治療法の開発に直結するものであり、今後の研究展開が糖尿病治療に貢献できることが期待されます。
- インスリン分泌の光学イメージング
- 光学イメージングによる2相性インスリン開口放出機構解明への挑戦
- 光学イメージングによる血管方向へのインスリン極性分泌の解明
- インスリン分泌におけるミトコンドリア品質管理の解明
研究内容
1. インスリン分泌の光学イメージング解析
インスリンは膵臓のランゲルハンス氏島にあるβ細胞内にあるインスリン顆粒に貯蔵されており、インスリン顆粒と細胞膜が融合することによって細胞外に分泌されます。
この様なインスリン開口分泌の分子機構を明らかにするためには、生きた細胞を用いて、単一インスリン顆粒の動態を、時間的空間的に解析することが必須です。
私達は、total internal reflection fluorescence microscopy (TIRF)システムを膵β細胞に応用し、世界で初めて、インスリンが膵臓のβ細胞から分泌される像を視覚的に捉えることに成功しました(図1)。
また解析により、インスリン開口分泌には2種類の形態があり、グルコース刺激前から細胞膜にドッキングしていた顆粒(Pre-docked顆粒)からの開口分泌と、
刺激後細胞膜へと輸送された後、細胞膜にごく短時間ドッキングして細胞膜と融合するインスリン顆粒(Newcomer顆粒)からの開口分泌により構成されていることを明らかにしました。
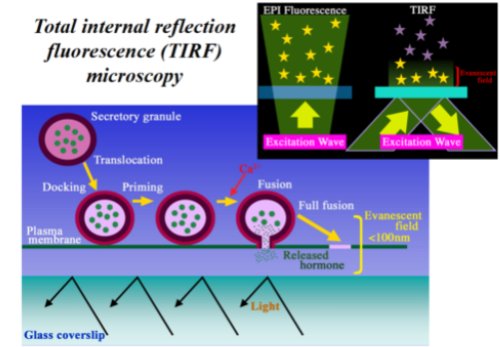
図1. Total Internal Refrection Fluorescence(TIRF)顕微鏡によるインスリン開口分泌イメージングシステム
2. 光学イメージングによる2相性インスリン開口放出機構解明への挑戦
食事の摂取により血中グルコース濃度が上昇すると膵β細胞からインスリンが2相性(第1相と第2相)に分泌されます。
2型糖尿病ではこの分泌2相性が失われ、分泌第1相の低下が引き金となって発症することから、2相性分泌のメカニズムの解明が強く望まれています。
私達は膵β細胞内インスリン顆粒のイメージング解析を行なった結果、
分泌第1相では主に細胞膜蛋白質であるSyntaxin 1A上にドッキングしているインスリン顆粒(Pre-docked顆粒)からインスリン分泌がおこり、
第2相ではSyntaxin 1Aとの相互作用なしにNewcomer顆粒から分泌されることを発見し、インスリン分泌第1相の詳細なメカニズムを初めて明らかにしました(図2)。
実際、2型糖尿病モデルラットβ細胞ではSyntaxin 1Aの発現が低下していることから、Syntaxin 1Aの発現・機能異常による分泌第1相の低下が2型糖尿病発症の直接の引き金になっていると考えられます。
私達はこのほかにも、Syntaxin 1Aに結合するタンパク質などが分泌第1相を調節している分子であることを明らかにしています(図2)。
また、第2相インスリン分泌についてもPI3キナーゼが調節していることを明らかにしました。
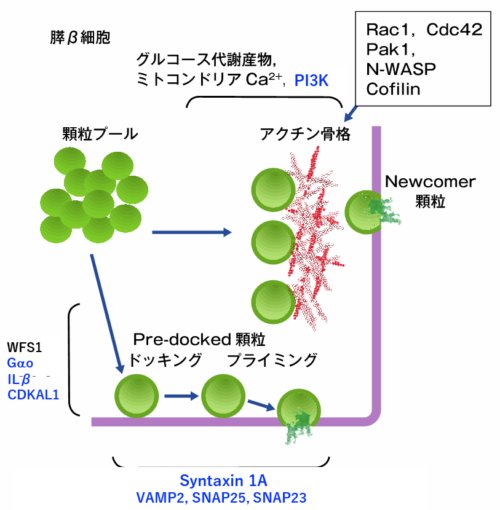
図2.膵β細胞からの2相性分泌におけるPre-docked顆粒とNewcomer顆粒からの開口分泌に関わる分子群
(このうち、私たちが明らかにした分子を青地で示す。)
青柳共太、今泉美佳(2020) 2相性インスリン分泌のメカニズム 月刊糖尿病 12:20-26より改変
3. 光学イメージングによる血管方向へのインスリン極性分泌の解明
実は膵島においてβ細胞は静脈系毛細血管を囲むように配置されていて、インスリンはβ細胞膜の毛細血管に面した領域から血管方向へ分泌されると考えられています。
しかし、どのようなメカニズムで血管方向へ優先的に分泌されるのかは解明されてはいませんでした。
私達はプレシナプスのアクティブゾーンタンパク質であるELKSが毛細血管側のβ細胞膜近傍に偏って局在していることを発見、
ELKSが毛細血管方向への第1相インスリン極性分泌をコントロールしていることを明らかにしました(図3)。
また私達は2型糖尿病モデルマウス膵島ではELKSの発現量が低下しており、β細胞からの第1相インスリン極性分泌が低下していることを明らかにしました。
この結果より2型糖尿病ではELKSによる血管方向へのインスリン極性分泌促進機構が破綻しており、インスリン分泌障害が引き起こされていることが示唆されました。
なお、私達は科研費基盤Bにより第2相インスリン極性分泌の解明に向けた研究もスタートさせています。
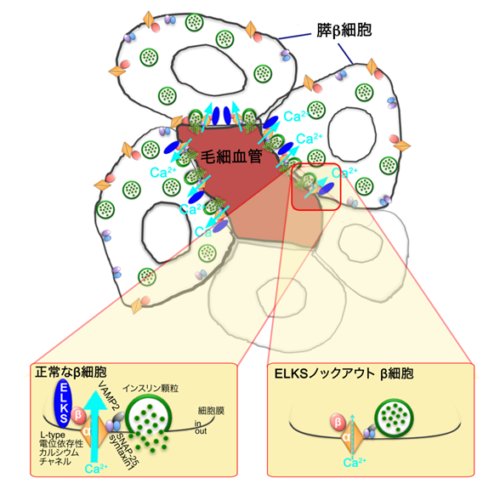
図3.膵β細胞においてELKSがインスリンを効率よく毛細血管方向へ分泌させる仕組み
毛細血管側のβ細胞膜に局在しているELKSはL-type電位依存性Ca2+チャネルと複合体を形成しており、
毛細血管側のβ細胞膜でグルコース刺激によって直ちに引き起こされるCa2+流入を促進させ、
結果、近傍のSyntaxin1上にドッキングしているインスリン顆粒の開口分泌を増大させ、インスリンを効率良く血管方向へ分泌させている。
ELKSを欠損させると、毛細血管側のβ細胞膜でのCa2+流入が低下し、インスリン分泌が低下する。
Ohara-Imaizumi et al. (2019) Cell Reports 26, 1213-1226 より
4. インスリン分泌におけるミトコンドリア品質管理の解明
膵β細胞は血糖上昇に伴って細胞内に取り込んだ糖をミトコンドリアで代謝することによってATPを産生し、インスリンを分泌しています。
ところが、ミトコンドリアは働き続けると有毒な活性酸素を産生して自身を傷つけてしまうことが知られています。
傷ついたミトコンドリアは、ATPを効率よく産生できないだけではなく、さらに多量の活性酸素を産生して細胞を死に至らせてしまうため、速やかに隔離・分解する必要があります。
これまでの研究から、マイトファジー(オートファジーによるミトコンドリア分解) と呼ばれる機構によって傷ついた不良ミトコンドリアを選択的に分解することで、
細胞はミトコンドリアの品質を維持していることが分かっています。
しかしながら、これまで膵β細胞におけるマイトファジーを調べることが技術的に困難であったため、膵β細胞におけるミトコンドリアの品質と糖尿病の関連についてはほとんど明らかにされていませんでした。
今回、私達は膵β細胞特異的マイトファジー可視化マウスの開発に成功し、肥満マウスの膵β細胞におけるミトコンドリア品質管理について調べました。
その結果、肥満マウスで生じる巨大化した膵島では、低酸素依存的にマイトファジーが増強される一方、
増強されたマイトファジーでも分解しきれないほどの不良ミトコンドリアが蓄積することでミトコンドリア品質が低下し、インスリン分泌低下が引き起こされることを見出しました(図4、5)。
この発見は、膵β細胞内への不良ミトコンドリアの蓄積を防止する新たな糖尿病治療薬の開発につながることが期待されます。
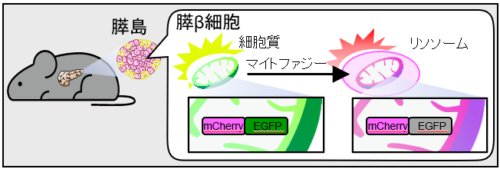
図4.膵β細胞特異的なマイトファジー可視化マウスの作製
膵β細胞のミトコンドリアにマイトファジーを検出するための蛍光センサーとして、pH感受性の異なる蛍光タンパクであるmCherryとEGFPを発現させた。
ミトコンドリアが細胞質にいる時はmCherryからの赤い蛍光とEGFPからの緑の蛍光の両方が観察されるが、
ミトコンドリアがマイトファジーによって酸性のリソソームへと輸送されると、EGFPは蛍光を発しなくなるため、mCherryからの赤い蛍光のみが観察されようになる。
すなわち赤い蛍光を観察することにより、マイトファジー活性が検出できる。
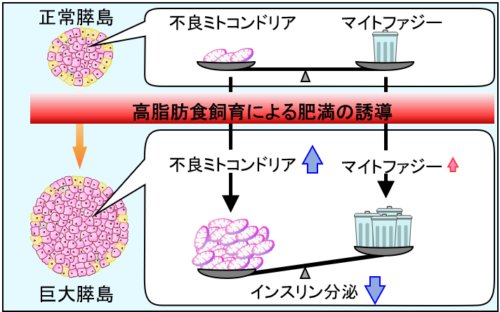
図5.肥満によって巨大化した膵島ではマイトファジーで分解しきれない不良ミトコンドリアが蓄積してインスリン分泌が低下する。
高脂肪食飼育によって巨大化した膵島では低酸素依存的にBNIP3が発現してマイトファジーが増強されるが、
増強されたマイトファジーでも分解しきれないほどの不良ミトコンドリアができてしまうことでミトコンドリア品質が低下し、インスリン分泌が低下する。