前立腺がんに対するウイルス療法の臨床試験 開始へ
作成日時:2022年02月14日
〜2021年治療薬が発売承認された新しいウイルス療法を前立腺がんへ応用〜
杏林大学医学部付属病院泌尿器科では、教授 福原浩を総括責任者として、転移性前立腺がん患者を対象にしたウイルス療法の臨床試験を開始します。これは、がん細胞だけで増殖するようにウイルス遺伝子を組み換えた人工的なウイルスを使ってがん細胞を破壊する、新しいがん治療法です。
使用するのは東京大学医科学研究所藤堂具紀教授らが開発した第三世代のがん治療用ヘルペスウイルスのG47Δ(じーよんじゅうななデルタ)で、2021年6月に、悪性神経膠腫を適応症として製造販売承認されたものです(一般名 テセルパツレブ、製品名 デリタクト注)。
G47∆は、全ての固形がんに共通のメカニズムでがん細胞を破壊する治療法であり、今回当院泌尿器科で行う臨床試験では、まだ治療を受けていない、転移のある前立腺がんの患者が対象となります。ホルモン療法を併用して、再発率をどの程度抑制するのかを調べるのが今回の臨床試験の目的です。今回の臨床試験は、有効性を検討するための第Ⅱ相試験となります。
【発表者】
杏林大学医学部付属病院 泌尿器科 教授 福原 浩
【臨床試験の概要】
対象疾患 :転移のある前立腺がん(ホルモン療法未使用)
試験デザイン:第Ⅱ相(*1)、対照群のないオープンラベル試験(*2)
投与方法 :MRI fusion経直腸超音波ガイド下に経皮的(経会陰部)に前立腺腫瘍内投与
1回目と2回目は5-14日の間隔、3回目以降は4週間の間隔をおいて6回投与
主要評価項目:1年後failure-free生存割合(無増悪生存割合)
実施施設 :単施設(杏林大学医学部付属病院)
試験開始時期:令和4年2月
*1 第Ⅱ相:今回の臨床試験は、G47∆の安全性を評価する第I相試験において前立腺内投与の安全性が確認されたことに基づき、比較的少数の被験者を対象にして治療効果を調べる第Ⅱ相試験の試験デザインとなっています。
*2 対照群のないオープンラベル試験:今回の臨床試験は、G47∆を投与される群と投与されない群(対照群)に患者が振り分けられることなく、被験者が全員試験薬であるG47∆を投与される試験法となっています。
【前立腺がんについて】
― 転移がんは治癒率が低い ―
前立腺がんは、転移していない状態で見つかれば、手術や放射線によって治癒が可能で、5年生存率も100%に近く、予後も良好です。しかし、転移した後に見つかると、治療を行っても約半数で癌死に至ります。転移のある前立腺がんには、まずホルモン療法(*3)が行われます。しかし、多くの場合、ホルモン療法の治療効果がなくなり、前立腺がんが再び勢いを盛り返して「再燃」の状態になってしまいます。 通常、「再燃」かどうかはPSA値(*4)が上昇してくることで判断します。ホルモン療法の治療効果がなくなってからは、直接前立腺に作用する薬剤や新規ホルモン療法薬、抗癌剤治療、最近ではゲノム医療などの治療が行われます。しかし、再燃した後は基本的には延命効果を期待する治療法となり、最初のホルモン療法が効いている期間を少しでも延長させることが重要となります。そのため、今回臨床試験を開始するウイルス療法のような、全く新しいアプローチによる治療法の開発が待ち望まれています。
*3 ホルモン療法とは、男性ホルモンの分泌や働きを抑えることによって、前立腺がんの勢いを抑える治療法(アンドロゲン除去療法)が基本です。さらに、直接前立腺に作用する薬剤や新規ホルモン療法薬を組み合わせることがあります。
*4 PSAとは前立腺特異抗原のことを示し、前立腺がんの腫瘍マーカーとして使われています。病勢をよく反映し、採血にて測定することができます。
【がんのウイルス療法とは】
― 正常組織を傷つけず、がん細胞だけを攻撃 ―
がんだけで増殖するウイルス(がん治療用ウイルス)は、がん細胞に感染して増殖し、そのがん細胞を死滅させます。近年、遺伝子組換え技術が発達したため、このような、がんだけで増殖するウイルスを人工的に造ることが可能となりました。がん治療用ウイルスは、がん細胞に感染するとすぐに増殖を開始し、その過程で感染したがん細胞を死滅させます。増殖したウイルスはさらに周囲に散らばって再びがん細胞に感染し、ウイルス増殖→細胞死→感染を繰り返してがん細胞を次々に破壊していきます。一方、正常細胞に感染した遺伝子組換えウイルスは増殖できないような仕組みを作ってあるため、正常組織は傷つきません(図1)。
ウイルス療法は世界でも欧米を中心に、がんの新しい治療法として開発が行われており、さまざまなウイルスが応用されています。特に、単純ヘルペスウイルスⅠ型は、口唇ヘルペスの原因となるありふれたウイルスですが、がん治療に有利な特長を多く備えているため、臨床開発が進んでいます。

【G47Δ(デルタ)とは】
― 世界に先駆け、日本で臨床試験が開始 ―
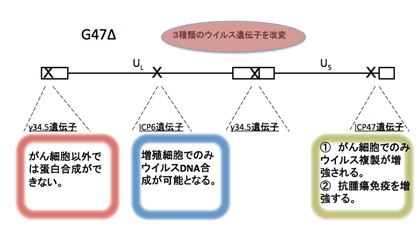
G47Δは、単純ヘルペスウイルスⅠ型の3つのウイルス遺伝子に改変を加えて作製された、世界初の第三世代のがん治療用の遺伝子組換えヘルペスウイルスです(図2)。
三重の改変によって高い安全性を獲得しながら、強力な抗がん作用を発揮することを実現しています。また、大きな特徴として、複製して増えたG47Δが、破壊したがん細胞とともに免疫に排除される過程で、がん細胞が免疫に非自己として認識されて、抗がん免疫が惹起されるため、G47∆を投与した部位のみならず、遠隔のがんに対しても免疫を介して治療効果が期待できます。さらに、G47∆は、がんの根治を阻むとされるがん幹細胞をも効率よく破壊することがわかっています。
現在世界で開発されているがん治療用ウイルスの中でも、もっとも技術的に進んでおり、世界に先駆けて日本で臨床開発が行われました。膠芽腫(悪性脳腫瘍)を対象として2015年から開始した医師主導治験では、治療開始後一年生存割合が中間解析において92%と、対照値15%(メタ解析に基づく)に比べ高い治療成績が示されました。この治験の最終解析の結果を受けて、2021年に悪性神経膠腫に対して製造販売が承認されました。G47∆は、全ての固形がんに共通のメカニズムでがん細胞を破壊するため、前立腺がんや脳腫瘍以外にも、あらゆる固形がんに有効であると考えられています。これまで、膠芽腫を対象とした臨床開発が2009年から行われ、2013年からは前立腺がんを対象とした臨床開発が行われました。また、2013年から嗅神経芽細胞腫、2018年から悪性胸膜中皮腫の臨床試験が東京大学医科学研究所で行われています。
【臨床開発について】
G47∆は、2021年6月に悪性神経膠腫を適応症とした再生医療等製品(一般名 テセルパツレブ、製品名 デリタクト注)として製造販売(*5)が承認され、8月には薬価も収載されました。市販後に本品を使用する患者全員を対象に7年以内に有効性・安全性の再確認を行うという条件及び期限付承認(*6)となっております。
今回当院泌尿器科での臨床試験に先行して、東京大学泌尿器科にてホルモン療法抵抗性前立腺がんに対する臨床研究を2013年5月から開始し、2016年3月に予定した全被験者への投与を終了しました。同9月には評価期間を終了、2018年3月には生存期間追跡も終了しております。この第Ⅰ相試験にて、前立腺内投与への安全性を確認しました。
本試験の正式名称は「前立腺癌に対するG47∆を用いたウイルス療法」です。開始するにあたり、2020年12月に杏林大学から東京大学臨床研究審査委員会(臨床研究法に定める認定臨床研究審査委員会)に審査委託依頼を行い、12月28日に同東京大学臨床研究審査委員会から承認を受けました。その後、厚生労働省に申請し、2021年7月9日付で厚生労働大臣の承認を受けました。また、増殖型遺伝子組換えウイルスを使用するため、「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」(カルタヘナ法)に則って、第一種使用規程の確認も受けております。
この臨床試験に用いるG47Δの臨床製剤は、東京大学医科学研究所の治療ベクター開発室の製造施設において国際基準(GMP)に準拠して藤堂具紀教授の研究チームが製造し、国際基準(GLP)の徹底した品質試験を実施して合格したものです。
G47Δの開発はこれまで、文部科学省「がんトランスレーショナル・リサーチ事業―革新的ながん治療法等の開発に向けた研究の推進―」(平成16(2004)年~平成20年(2008)度)、文部科学省「橋渡し研究支援推進プログラム」(平成19(2007)年~平成23(2011)年度)、文部科学省「橋渡し研究加速ネットワークプログラム」(平成24(2012)年度~平成28(2016)年度)、内閣府「最先端研究開発支援プログラム」(平成21(2009)年~平成25(2013)年度)、厚生労働省「革新的がん医療実用化研究事業」(平成24(2012)年〜平成26(2014)年度)、日本医療研究開発機構(AMED)「革新的がん医療実用化研究事業」(平成27(2015)年〜令和2(2020)年度)などの支援を受けており、東京大学医科学研究所の藤堂具紀教授が、大学発・研究者主導のトランスレーショナルリサーチとしてこれまで進めてきたものです。本臨床試験もAMED「橋渡し研究戦略的推進プログラム」(平成29(2017)〜令和3(2021)年度)の支援を受けて実施します。
*5 製造販売承認とは、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法)に基づいて、医薬品等の製造および販売を厚生労働省が承認することです。ウイルス療法を含む遺伝子治療等は再生医療等製品という製品分類に属します。
*6 条件及び期限付き承認とは、有効性が推定され、安全性が確認されれば、条件及び期限付きで特別に早期に承認できる制度に基づいた承認のことです。市販後一定期限内に有効性・安全性を再確認することが条件になります。G47∆(デリタクト注)は、7年の「期限」内に使用患者全例を対象に検証を行うことを「条件」に承認されました。なお、条件及び期限は製薬企業に課されるものであり、患者の立場からは、通常の承認と何も変わりません。
【臨床試験への参加】
本試験に参加を希望される患者さん、あるいは照会を希望される医療関係者は、【泌尿器科学教室のホームページ】からお問い合わせください。
「ウイルス療法」の問い合わせフォームに記入し、「送信する」をクリックしてフォームを送信してください。試験チームよりご連絡致します。
【参照HP】
・杏林大学医学部付属病院 泌尿器科
・ 東京大学医科学研究所附属病院 脳腫瘍外科
杏林大学医学部付属病院
泌尿器科 教授 福原 浩、広報室


